【异倍性系列3】——chromosome instability 染色体不稳定性 (CIN)
介绍染色体不稳定性的机制。
一、 背景
非整倍体和CIN之间的界限是模糊的,因为没有工具可以区分非整倍体(描述细胞核型的一种状态)和CIN(染色体错分离率增加)。
这种区别很重要,因为一种染色体倍数可以以不同的方式产生,单染色体通过CIN可能是最常见的非整倍性途径。
二、造成CIN的因素
正确的染色体分离过程中,需要染色体在细胞周期的G2和M期保持内聚,然后在后期开始时突然中断。
2.0 有丝分裂中的染色体分离
有丝分裂是经过精心设计的,为了确保所有的姐妹染色单体分裂到不同的子细胞中,其中姐妹染色单体的cohesion是关键,它存在于DNA复制时,是通过the deposition of the cohesion complex建立的,在细胞周期的G2和M期保持,在后期开始时突然中断。精准的时间控制是通过周期蛋白依赖性激酶和SAC(spindle assembly checkpoint)的协同活动决定的。
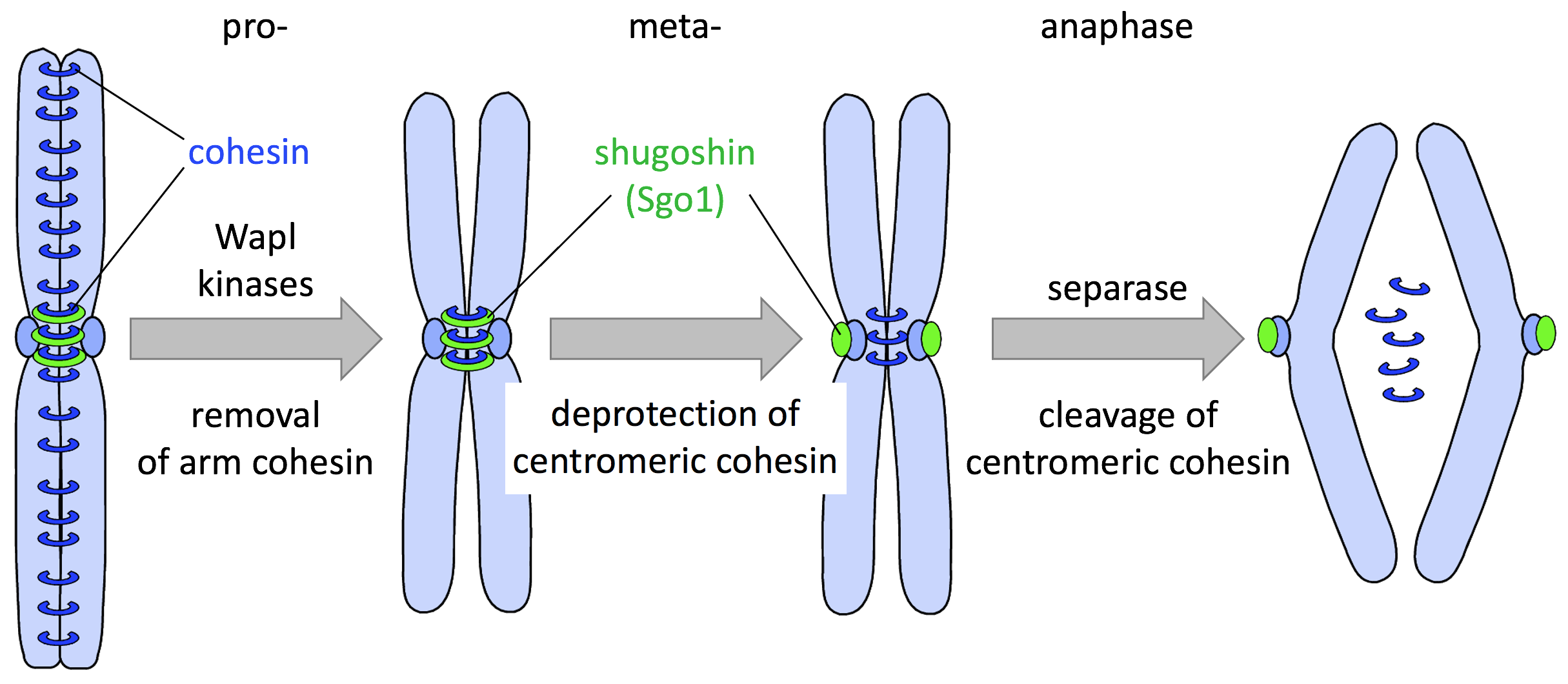
cohesion
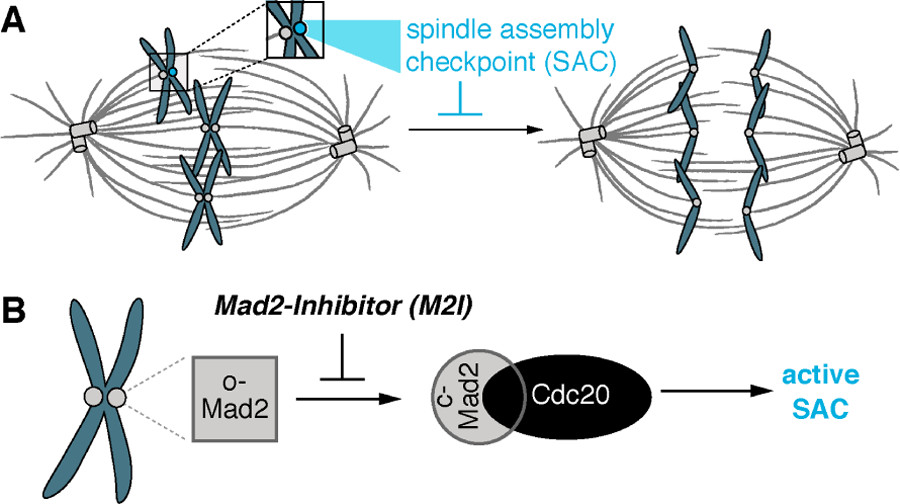
SAC
染色体不合时宜地附着到纺锤体微管时,发出维持周期蛋白依赖性激酶活性的信号,会抑制后期的开始并阻止姐妹染色单体cohesion,比如,单向染色体没有附着到单个着丝粒上会出发等待后期的信号,而且,一个单个的没有附着的着丝粒足以阻止后期的发生。一旦所有的染色体都附着到正确的两个方向的着丝粒上,SAC满足条件,姐妹单色单体会突然分离,同时通过细胞周期机器诱导所有的染色体水解性地分裂复合体内聚物,最终,人类细胞的每个着丝粒平均附着了大约20个微管,每个微管都朝向同样的spindle pole来支持公正的染色体分割。但是着丝点-微管连接的随机性质导致了频繁的错误连接,其中单个着丝点同时与来自主轴两端的微管相结合——称为“嵌合”(merotely)。这种嵌合附着通常发生在早期有丝分裂中,并且不被SAC感知,会造成姐妹染色单体在后期迁移到一个spindle pole,造成染色体错误分离。
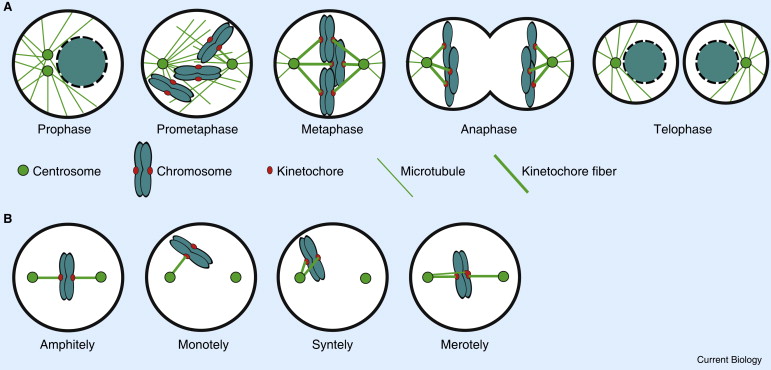
着丝点-微管连接类型
和CIN有关的蛋白质:https://www.cell.com/action/showFullTableHTML?isHtml=true&tableId=tbl1&pii=S0960-9822(10)00076-X
2.1 Cohesion defects
参与染色体cohesion的蛋白质是通过测量出芽酵母中的the efficiency of transmission of minichromosomes来确定的。研究发现,出芽酵母中诱导CIN产生的基因(基因产物调控姐妹染色单体cohesion,包括cohesion complex的subunits)突变,在人类肿瘤中存在。不过没有直接的研究检验这种突变如何影响染色体cohesion。所以,还不知道细胞是倾向于姐妹染色单体过早分离或在后期开始时染色体分离失败,从而无法评估它们在CIN中的作用。另外,然而,利用RNA干扰,cohesion或cohesion调控因子Sgo1/分离酶的急性严重耗散会增加四倍体细胞的数量。四倍体细胞也会发生在过表达分离酶或不耗散形式的securin(分离酶抑制蛋白:切割cohesion激活分裂后期),这表明,cohesion的失调趋向于造成染色体分离全局性的影响,而不是增加单个染色体分离的错误发生。另外,可能cohesion subunit的显性突变通过阻止及时的染色体分离来增加染色体错误分离率,这一点和细胞融合实验中CIN的主要行为吻合。另一种值得探讨的观点是cohesion subunit的突变是否破坏了着丝粒染色质的有序排列,从而导致姐妹着丝粒典型的背对背定向的破坏。除了这些特定的突变,还有其他迹象表明 cohesion的破坏可能导致CIN。比如,例如,与正常组织对照相比,乳腺癌肿瘤样本中分离酶水平较高,过多的分离酶可引起姐妹染色单体过早分离,导致染色体错分离。然而,由于肿瘤和正常组织有丝分裂指数的差异,对肿瘤中mRNA水平改变的解释尚不清楚。这种差异是普遍存在的,并且适用于比较正常组织和肿瘤组织的许多其他领域。
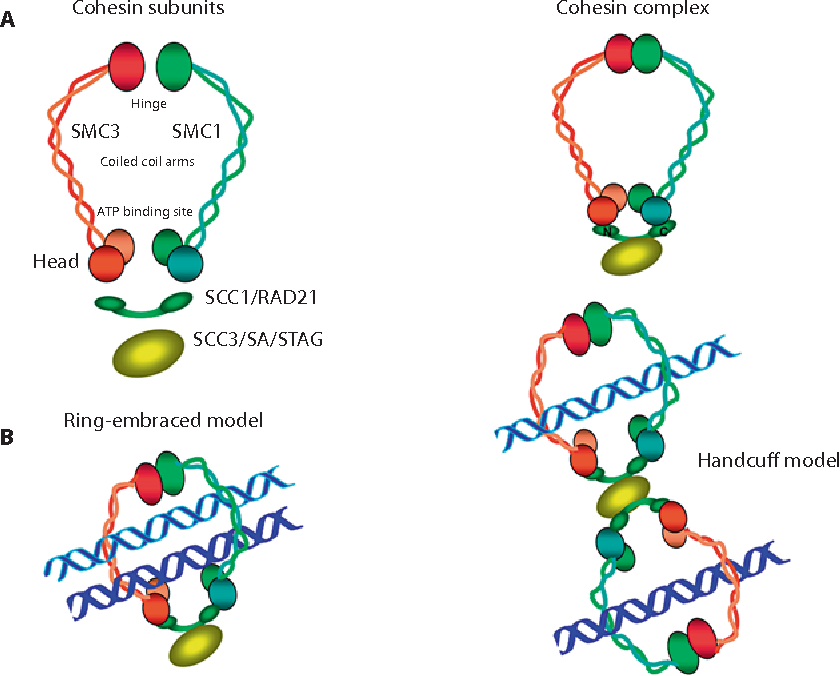
cohesion complex and cohesion subunit
2.2 SAC defects
2.3 Supernumerary centrosomes
2.4 Defect in Kinetochore-microtubule attachment dynamics
2.5 Defect in cell-cycle regulation
三、CIN作为靶点
四、CIN的检测方式
五、细胞能够耐受多少CIN
六、CIN和肿瘤免疫、炎症、转移之间的关系
染色体不稳定性的程度和部位决定了其致癌潜能https://www.nature.com/articles/s41467-020-15279-9
七、CIN的作用
CIN和异倍性在肿瘤形成的过程中的作用还不清楚。小鼠模型中显示,CIN会偶然展示出散点的、继承性的长期潜伏的状态,主要是肺和脾脏中国,这表明CIN不是一个潜在的癌症驱动因素。在倾向性获得癌症的小鼠中,CIN在不同的情况下,能够促进肿瘤形成,或抑制肿瘤形成。
异倍性虽然是CIN造成的,但是异倍性也会诱导CIN,实验发现,多一条染色体的细胞通常会产生更多的扩增或缺失。[The presence of extra chromosomes leads to genomic instability]此外,这些细胞表现出CIN的原因和/或特征,如(超细)后期桥,微核,染色体错误分离和胞质分裂失败。CIN通常会造成异倍性,因为CIN总是导致结构或数目异常。
有丝分裂由数个关键蛋白严格调控的过程,但是也会发生错误,比如由于有丝分裂调控因子发生突变的情况下,一些有丝分裂错误会造成异倍性。例如,纺锤体微管在染色体上的错误附着导致染色体的错误分离,导致数量非整倍体。另外,来自相反方向/子细胞的多个纺锤体微管的附着可以有效地“撕裂”一条染色体,导致两个子细胞获得或失去染色体的一部分,导致结构非整倍体。非整倍体在有丝分裂过程中变得明显,它可能是由有丝分裂之前的过程引起的,例如DNA损伤或复制应激,还有很多缺陷被认为是癌症CIN的基础,比如有丝分裂检查点错误,lagging 染色体(Whole chromosome instability and cancer: a complex relationship),anaphase bridges,mono-multipolar spindles,cytokinesis failure,telomere dysfunction,replication stress,DNA damage等等。然而,需要注意的一点是,从患者肿瘤中确定CIN的机制是非常困难的。此外,许多研究集中于来自不同肿瘤组的细胞系,而CIN机制可能因肿瘤类型和潜在患者而不同(作者未发表的观察结果)。此外,最近的研究发现,染色体错分离在非转化细胞中具有非随机模式,一些染色体的错分离明显高于其他染色体。[Non-random mis-segregation of human chromosomes]常见脆弱位点(Common vulnerable Sites, CFSs)是已知的当细胞经历复制应激时,染色体内更容易破裂的位点,导致结构非整倍体[Genomic instability in fragile sites—still adding the pieces],这些研究表明,不管是数量还是结构异倍性,都可能发生在非随机的基因组位点,因此,有可能由于染色体不稳定机制不同,在不同类型的癌症中这种模式是不同的。
除了细胞核的染色体改变外,CIN还能促进异常细胞结构的获得,如微核。微核是含有少量遗传物质的小核结构。这种遗传物质可以是染色体分离时滞后的单个染色体,也可以是DNA损伤[Cell biology: the micronucleus gets its big break]造成的破碎DNA片段。微核含有较少的DNA修复和复制机制,往往容易破裂,增加了染色体异常的进一步积累[Chromothripsis from DNA damage in micronuclei]。它们还可以激活先天免疫系统,因为DNA释放到细胞质中。
- CIN can only be measured in living cells
作用总结
-
CIN在不同的情况下,能够促进肿瘤形成,或抑制肿瘤形成
-
异倍性虽然是CIN造成的,但是异倍性也会诱导CIN
-
CIN还能促进异常细胞结构的获得
-
CIN率可能比单独评估非整倍体率更能预测肿瘤结局
参考文献
-
[1] Mechanisms of Chromosomal Instability
-
[2]Sister Chromatid Cohesion Control and Aneuploidy
-
[3]Sister chromatid cohesion and separation