拷贝数变异机制
基本框架
拷贝数变异的博客框架:
-
介绍拷贝数变异的从属关系,和结构变异的关系;克隆性拷贝数变异和亚克隆拷贝数变异
-
拷贝数变异检测手段,拷贝数变异检测方法/算法(这个比较多,可以分多点讲)
-
结构变异的检测手段等等
-
引发拷贝数变异的机制
-
拷贝数变异的应用价值
-
拷贝数变异的最新研究动向
该博客的框架:
-
简单过一下拷贝数变异的介绍。
-
详细阐述每一种拷贝数变异的机制和机制发现的过程。
癌细胞中的基因组变异可以分为两种主要的类别:
(1)小的变异:单核苷酸变异,双核苷酸变异,以及小的插入和缺失等等。
(2)大的变异:结构变异。
这里的大小是人为界定的,界定范围一般是50bp。(patterns and mechanisms of structural variation in human cancer)相比较结构变异,拷贝数变异的检测相对容易。
Yi and Ju 2018
传统的细胞生成技术把结构变异分成了简单的四类:大的删除、扩增、易位和倒位。全基因组测序分析表明,很多结构变异不是独立的事件造成的,而是通过“单次命中(single-hit)”获得的,因此是复杂的基因组重排。下面介绍一些肿瘤中发现的复杂的重排模式。
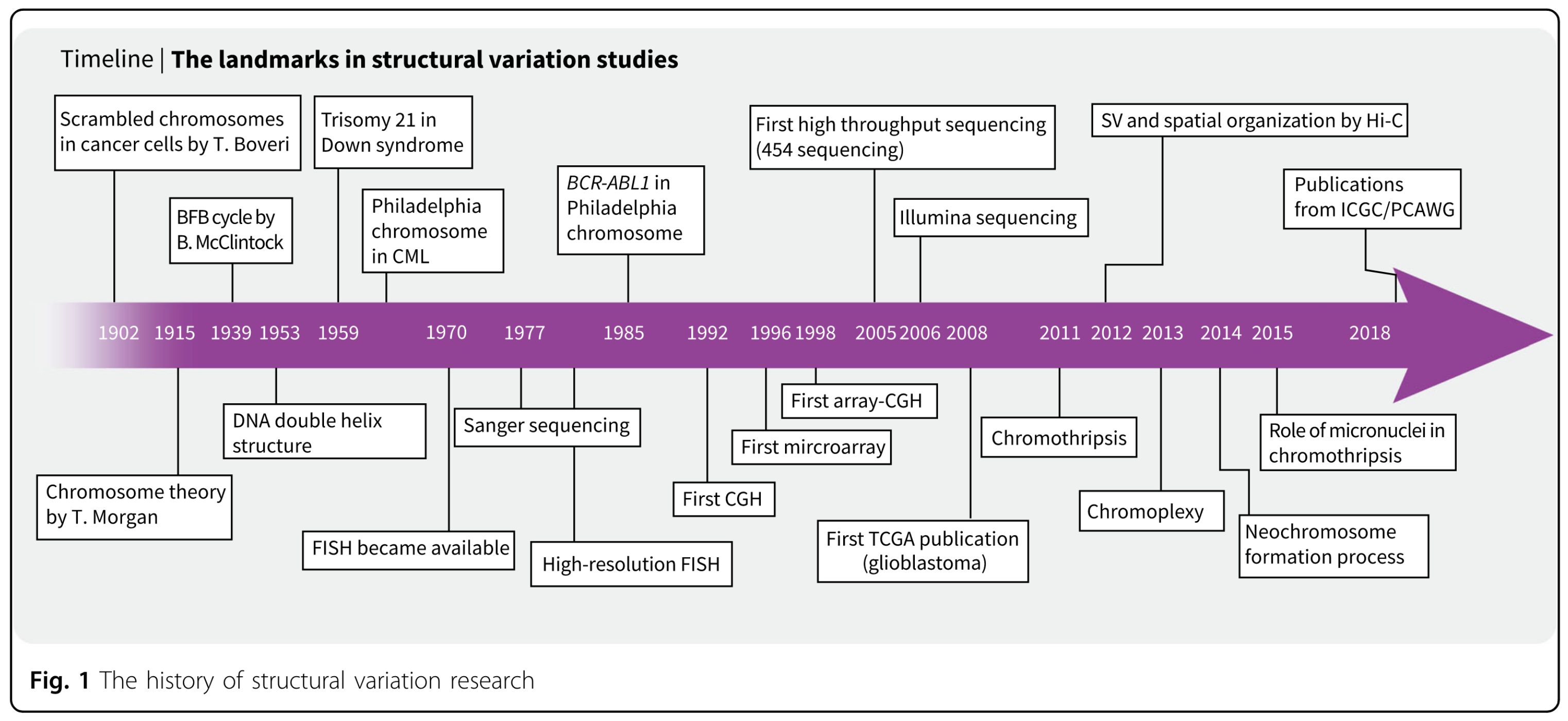
染色体碎裂(chromothripsis)
1. 概念介绍
染色体碎裂于2011年首次被定义,命名含义:染色体被切成碎片(2011)。它是受到大量的(可以超过100个)结构变异断点影响的复杂的重排模式,主要集中在一个或几个染色体臂上(Korbel,J.O. & Campbell, P.J.2013)。通常情况下,染色体碎裂在约3%的肿瘤中出现,尤其是骨癌(25%)和脑癌(10%)中较为常见。(2011)但是对于其患病率和癌症类型特异性仍比较模糊。染色体碎裂涉及到的染色体臂的拷贝数变异只在两种状态间震荡变化(1个拷贝或2个拷贝,偶尔出现3个拷贝的情况),在删除和正常的拷贝数状态之间变化,另外,杂合性缺失(LOH)在DNA拷贝数区域出现频繁。
2. 染色体碎裂模式
最简单的解释染色体碎裂发生的模式是:在肿瘤细胞中的单次灾难性打击,同时将一个或几个染色体臂粉碎成数百个DNA片段,随后DNA修复通路(可能是NHEJ,这个后续会提到)将片段重新组装,但是是以错误的排序和方向进行的组装,在修复过程中没有参与重新组合的片段发生了丢失从而发生了删除事件,最终结果形成了染色体碎裂。
上述解释了染色体碎裂在基因组上的特征,但是对于灾难性打击事件并不了解。目前有两种互斥的机制:
(1)端粒危机:端粒短化,末端和末端的染色体融合,形成染色质桥(41)
端粒(telomere)是染色体末端保护染色体的DNA区域,当端粒缩短,染色体末端(chromatid)可能会融合,形成具有双着丝粒(dicentric)的染色体,从而在有丝分裂中不能够分开进行子细胞,融合位点在有丝分裂后期伸展,形成染色质桥。在某些情况下,该桥诱导核膜在后期部分破裂,3 ‘修复外切酶1 (TREX1)的核酸酶活性产生大量的单链DNA和桥断裂[42]。在子细胞中观察其结构变异情况,容易发现其存在已知染色体碎裂存在的特征,以及局部超点突变(kataegis)。这个机制可以解释为什么染色体碎裂容易发生在端粒附近。
(2)有丝分裂时染色体错分离,形成微核(18)
在染色体上异常的核结构(微核)造成的物理隔离可能是染色体碎裂产生的机制。微核通常由于细胞分裂错误造成,比如在有丝分裂期间完整染色体的错误分离(43)以及异常DNA复制或修复过程产生的无着丝粒的基因组片段。微核中的分子过程容易出错,被分离出来的遗传物质被大量的分解成碎片,并重新组合,重新连接的DNA片段,显示出染色体碎裂的特征,并且被固定在子细胞中。
Yi and Ju 2018
3. 染色体碎裂的定量/界定
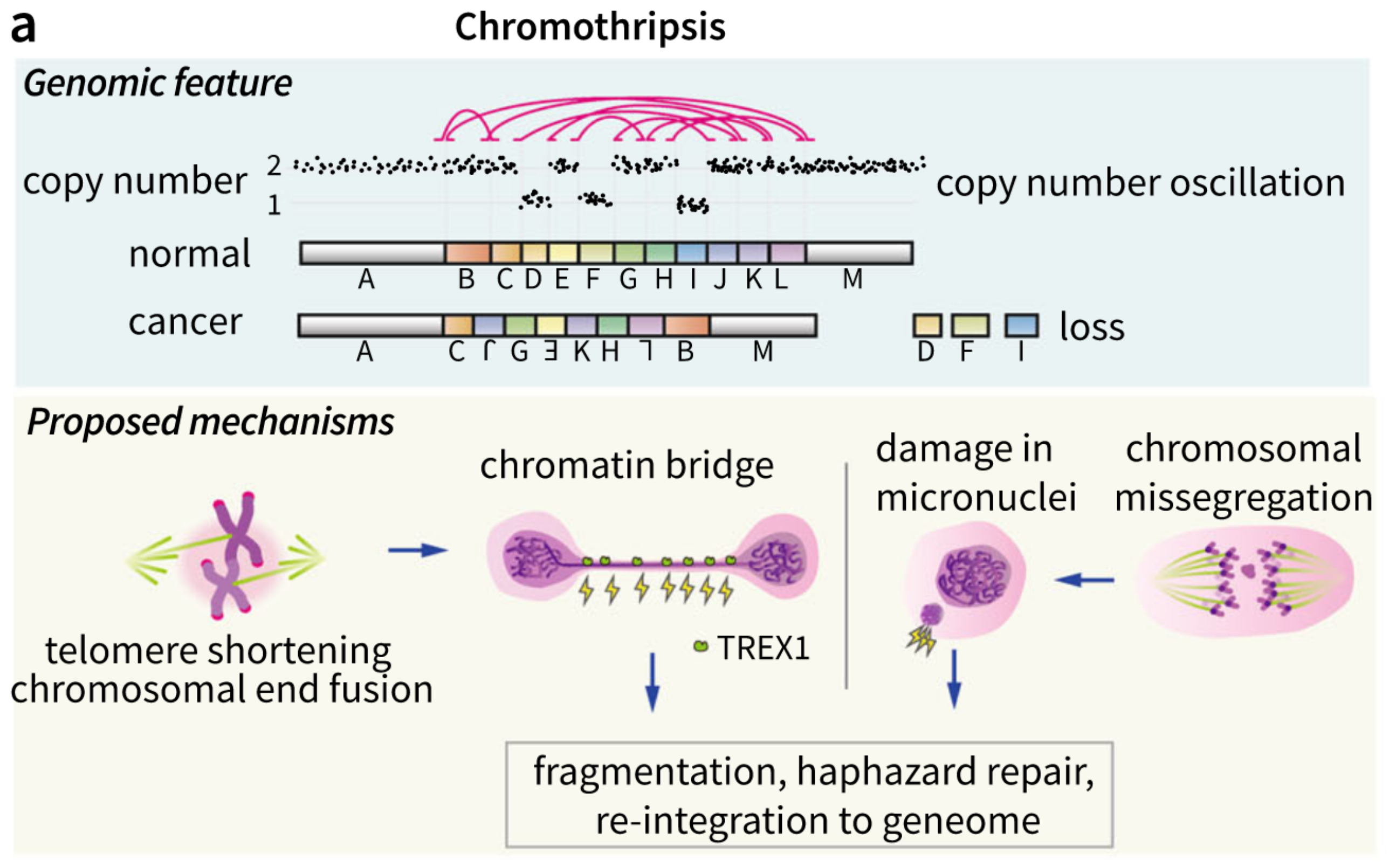
chromoplexy
1. 概念介绍
chromoplexy是扩展了的平衡易位(balanced trandslocation),重新洗牌了很多染色体(超过两个染色体),结构变异在chromoplexy事件中通常涉及到超过3个染色体,并且是一个闭环“closed chain”的重排模式,尽管有小的删除会偶然的结合在断点周围形成“删除桥”,在chromoplexy时间中大部分的结构变异是拷贝数中性的。chromoplexy有很多相互依赖的结构变异断点(大部分是染色体易位),但是数量比染色体碎裂要少,这种现象在前列腺癌中发现(46),其发生的比例约90%,并且未在其他癌症类型中发现(截止文章发表的2018年)。chromoplexy机制通常是会破坏肿瘤抑制基因(比如:PTEN、TP53和CHEK2等等),并通过融合基因的形成来激活致癌基因(oncogene)(比如:TMPRSS2-ERG),
2. chromoplexy和染色体碎裂的异同点
-
同:都是由于一次
灾难性打击后(不是相同的灾难性打击),产生了很多DNA双链断点。 -
同:染色体碎裂和chromoplexy都是:破碎+缝合,因此几乎不涉及到扩增,尽管chromoplexy有小的删除,但绝大部分chromoplexy是拷贝数中性的。
-
异:染色体碎裂只限于染色体臂,chromoplexy则分布在染色体上,不过双链断点的分布并不是随机的,而是富集在转录活跃的和开放的核染色质区域(48-50)。这表明了核转录中心,这个在空间上聚集了很多共同调控的基因组区域的部分,由于一次
灾难性打击被片段化了。但是这个灾难性打击并不清楚是什么。
Yi and Ju 2018
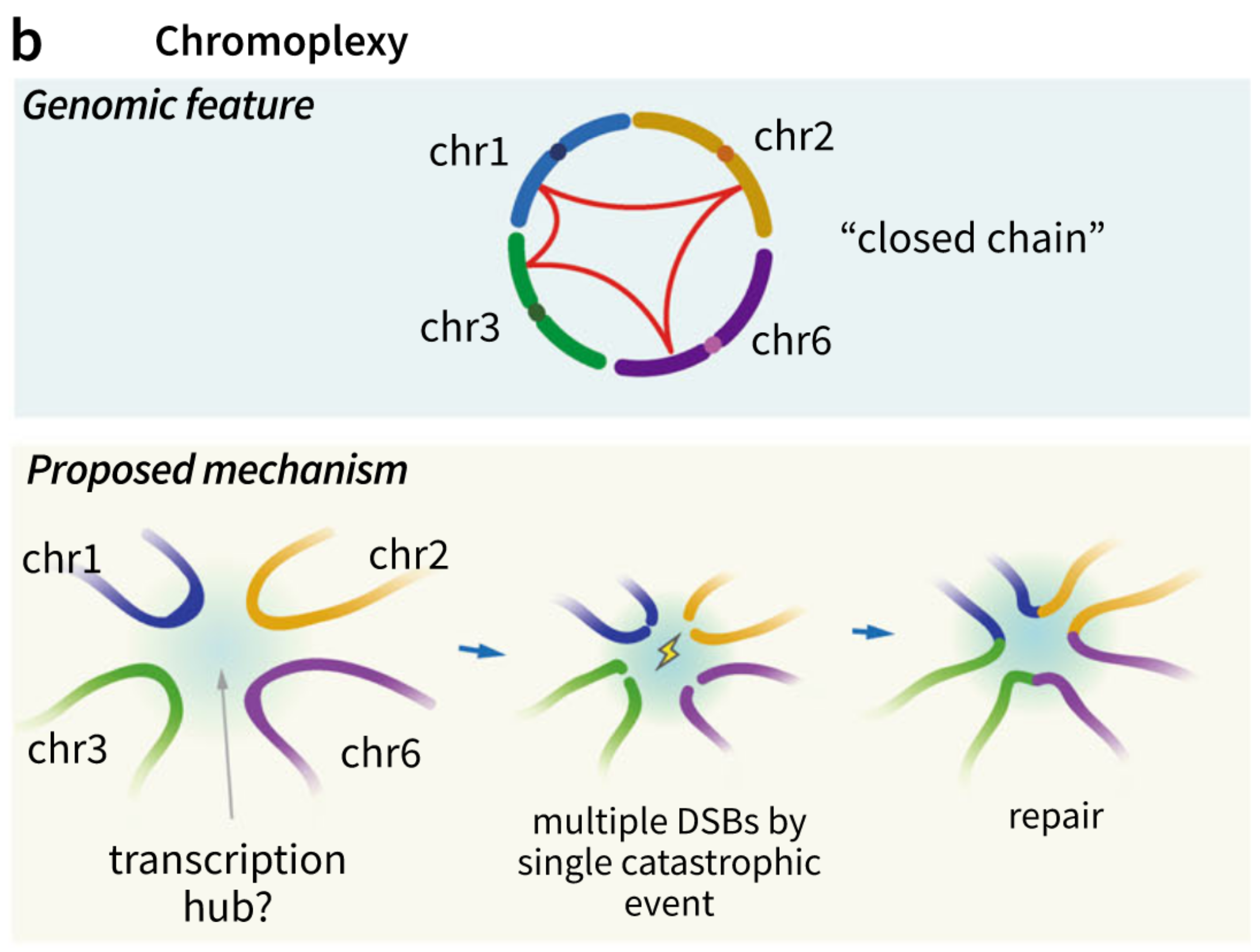
微同源介导的双链断裂修复(microhomology-mediated break-induced replication, MMBIR)
1. 概念介绍
一个父位点导致的大量散布的拷贝数扩增,这些扩增子直接和常见的微同源(2-15bp)以及模版插入在断点连接处相互连接,该模式最开始是用来解释种系拷贝数变异的,研究假设:跨损伤DNA聚合酶比如Rev1等等参与产生了MMBIR(53)。
细胞条件下诱导MMBIR产生的机制仍不明确。研究假设:由于大量的DNA加合物或/和单链DNA断裂干涉了正常DNA的复制,并刺激了模板的转换(?),形成破损复制叉(replication fork),通常为了修复破损的复制叉,模板的转换使用了姐妹染色单体,但是这个过程有利有弊,该修复过程在选择非等位的(non-allelic)染色体区域作为模板时,会导致染色体重排。
总结:扩增;复制叉
Yi and Ju 2018
断裂融合桥(breakage-fusion-bridge cycle, BFB cycle)
1. 概念介绍
断裂融合桥首次在1939年被发现(57),当两个着丝粒在细胞后期被撕开时,端粒融合和断裂形成了具有双着丝粒的环,在部分细胞周期中,两个着丝粒中间随机形成了随机的大量双链断裂点,断裂融合桥环的典型特征就是重排,包括:
-
在亚端粒区域的stair-like增加(?)[41]
-
在断点处的fold-back inversion的富集
BFB环调控的结构变异在急性淋巴细胞白血病的亚型中展现出来,涉及到21号染色体的染色体内扩增,以及RUNX1基因的扩增。
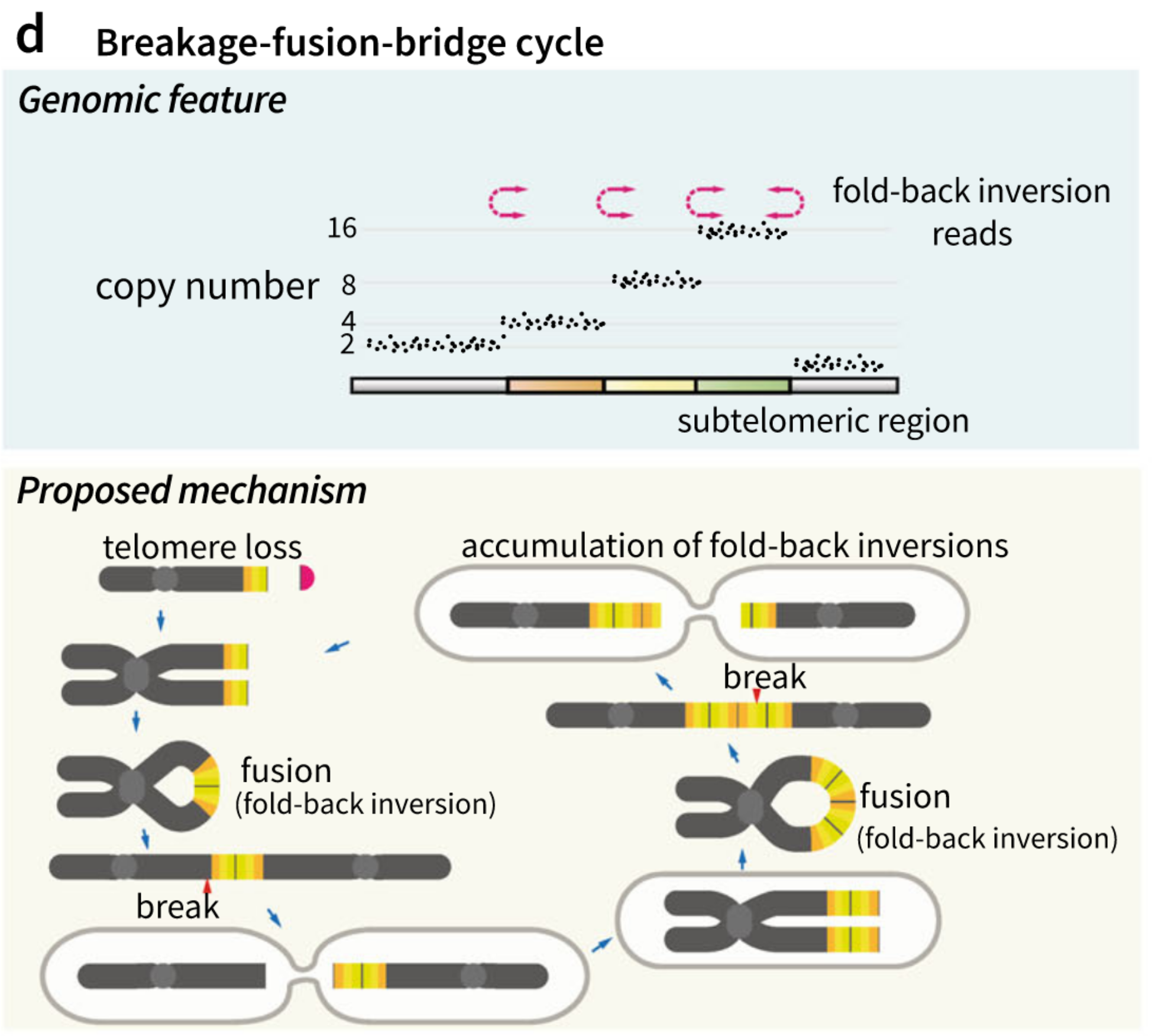
Yi and Ju 2018
同源重组修复缺陷(homologous recombination repair defect, HRD)
1. 概念介绍
同源重组(HR)是使用一致的或相似的DNA序列来修复双链断裂的基本细胞机制,同源重组的步骤通常是:
(1)切除双链断裂的5‘【这段检查一下】
(2)把3’端悬挂的部分匹配到一致的或类似的DNA片段上【是不是避免发生而不是推动发生】
(3)DNA修复使用1个或2个通路——double-holliday junction[62]或synthesis-dependent strand annealing
双链断裂修复缺陷(比如:BRCA1和BRCA2的失活)造成了基因组的不稳定【这个增加风险是如何得到该结论的???见下图64,65】,并且增加了乳腺癌和卵巢癌的风险。通常,在同源重组通路中,BRCA1伴随ATM,TP53和CHEK2来识别DNA双链断裂,BRCA2在加载(loading of)RAD51中起到重要作用,RAD51是5‘末端切割后链匹配必须的基因,在7%的乳腺癌患者中发现BRCA1和/或BRCA2完全失活,尤其是三阴性乳腺癌中。

1994
BRCA基因突变的乳腺癌患者和其他乳腺癌患者相比存在更高的结构变异负荷,根据失活基因,发现了结构变异的特殊的模式。比如,BRCA1失活的肿瘤中主要是短的(<10kb)串联重复(tandem duplication),BRCA2失活的肿瘤主要是删除[68],
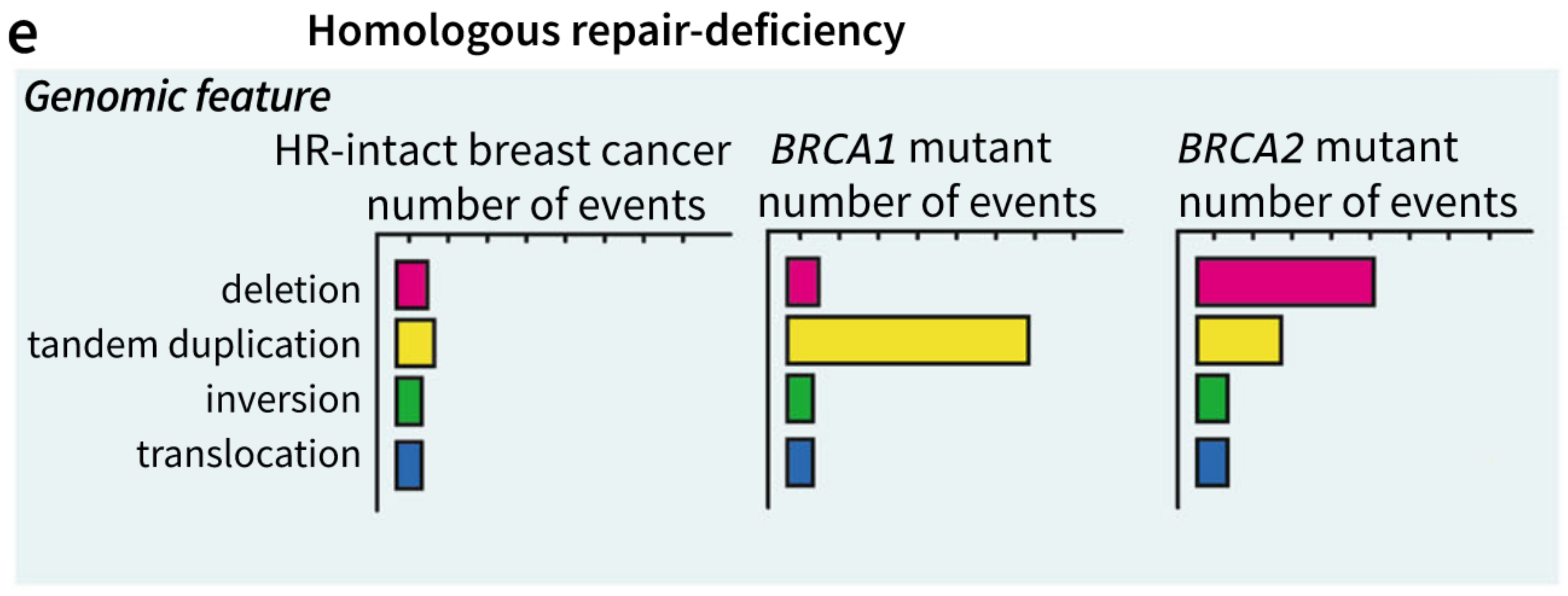
2018
HRD在临床上非常重要,因为其存在靶向药物(PARP抑制剂)来抑制碱基切除修复通路,通过靶向其他的基因组不稳定性作用于同源重组修复缺陷的细胞,只使得肿瘤细胞死亡。【如何进行靶向的如何把靶向HRD的肿瘤细胞呢】
双微体和新染色体(double-minute chromosome and neochromosome)
1. 概念介绍
双微体是缺少着丝粒的小环形的异常基因组片段,双微体通常在血液和实体瘤肿瘤细胞中大量扩增,在40%的恶性胶质瘤中存在,部分致癌基因比如CDK4,MDM2,EGFR等在双微体中一起扩增。双微体在肿瘤发生和肿瘤克隆性演化中[78,79]非常重要。
新染色体(neochromosome)是异常的环形或线形的基因组片段。和双微体不同,新染色体有着丝粒结构和端粒区域(如果是线形的),新染色体在3%的癌症中出现,尤其是间叶性肿瘤【什么是间叶性肿瘤】[80],脂肪肉瘤的基因组可以阐述新染色体的形成。[81]。和双微体一样,新染色体初始是环状DNA结构,中间的结构随后抓住着丝粒,最终通过双末端获取端粒形成线形。
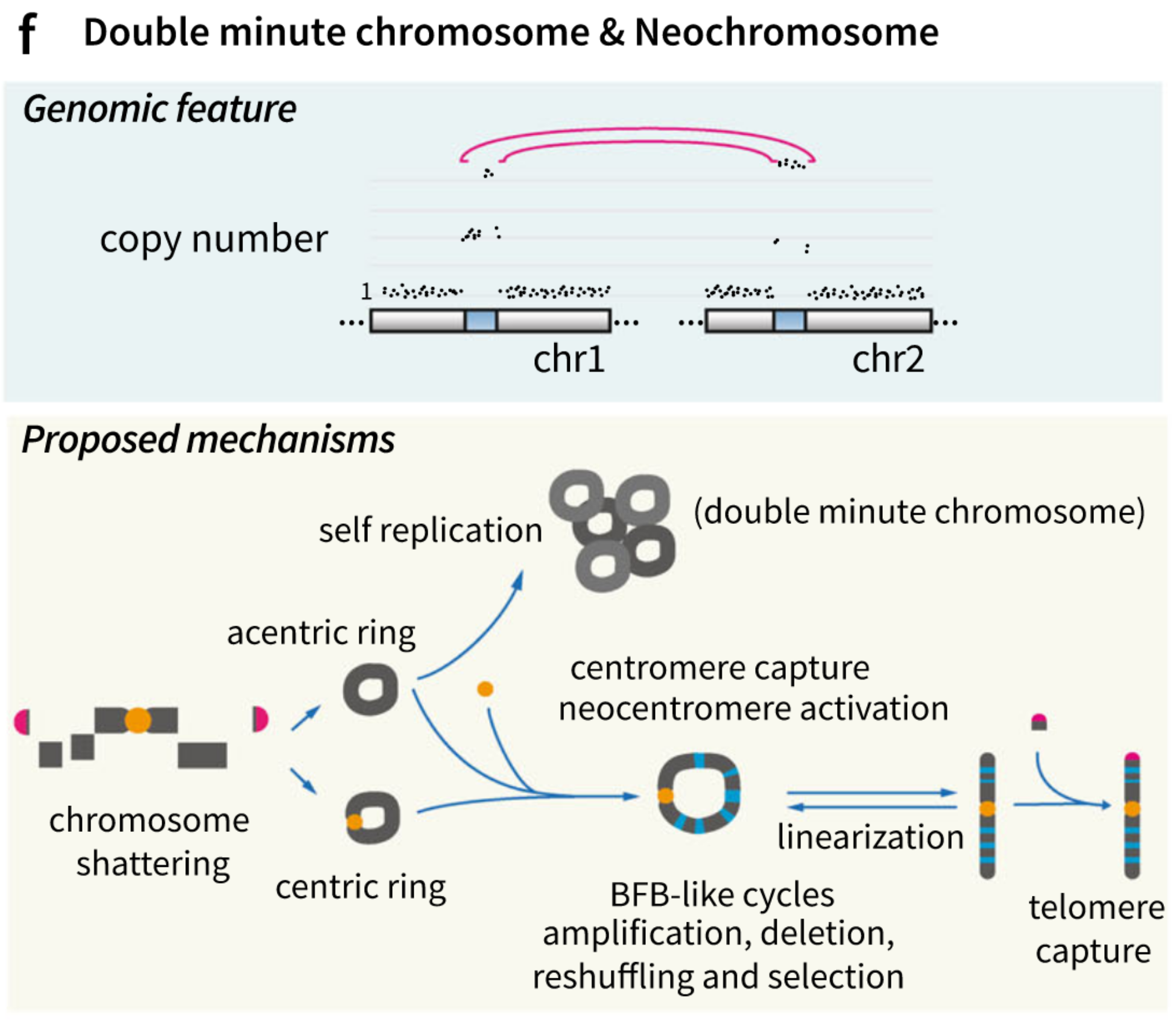
2018
可移动原件的转座(transposition of mobile elements)
1. 概念介绍
转座子(transposable elements,TEs)是人类基因组上占据45%的重复的DNA序列[82],这些元件通过“剪切-粘贴”(DNA转座)或“拷贝-粘贴”(逆转录转座子)的方法产生结构变异,在基因组演化过程中产生重要作用,人类基因组中大部分的转座子在种系和体细胞中是缩短和不活跃的(肿瘤细胞中存在比较频繁的现象,比如L1逆转录子),
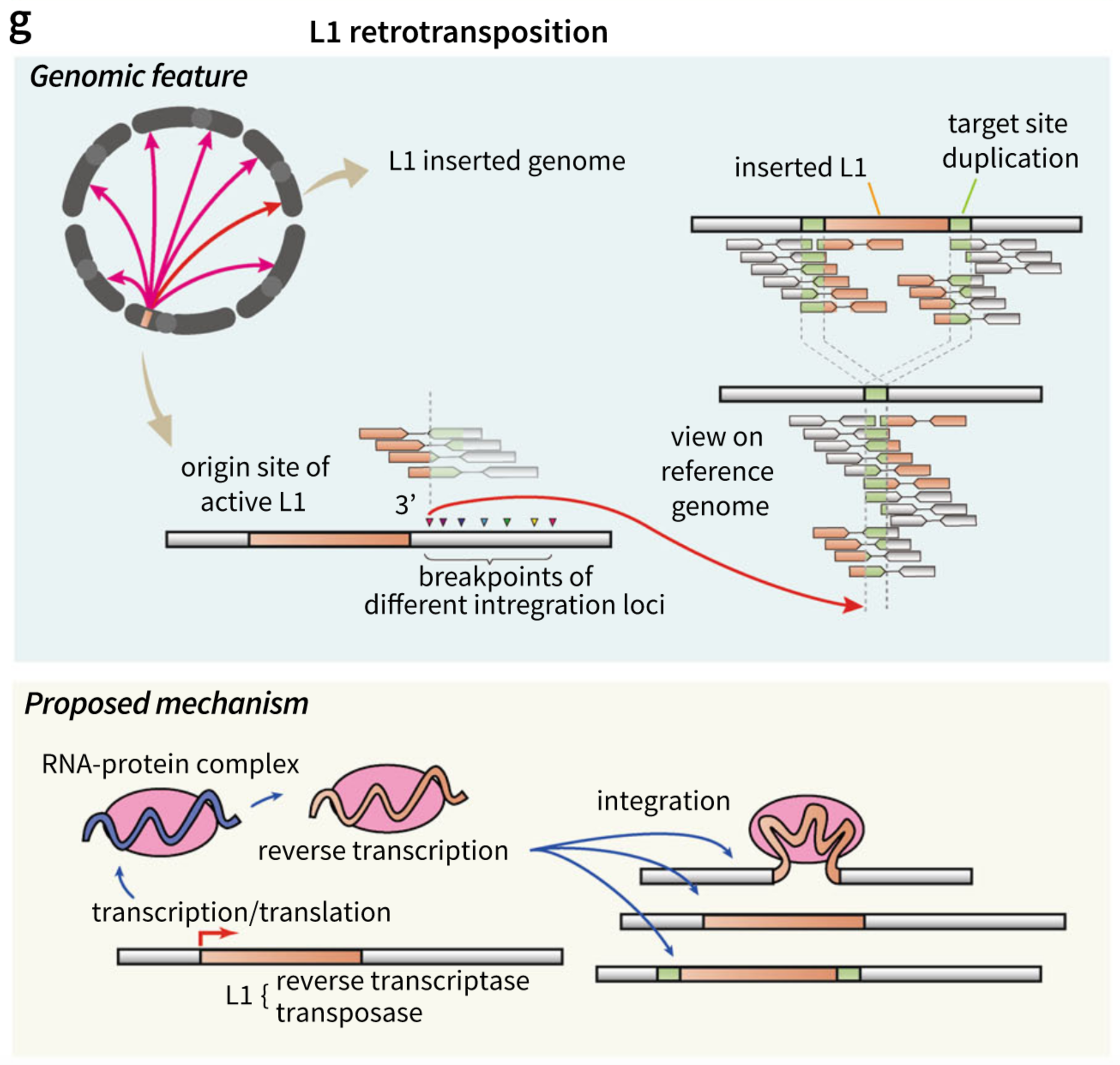
2018
外源性DNA的插入(insertion of external DNA sequence)
1. 概念介绍
除了对核基因组进行重新洗牌的方法,肿瘤细胞可以从病毒、线粒体和细菌中获取崭新的核外DNA序列,比如超过95%的宫颈癌和12%的头颈癌患者的基因组中含有HPV的DNA序列,HPV基因组整合直接涉及到肿瘤发生(例:通过HPV的致癌基因E6来抑制P53通路)以及导致基因组不稳定性的发生。HPV插入的区域会通过“环调控机制”频繁扩增,插入的区域趋向于形成环结构,基因组DNA片段由于病毒插入会扩增超过50倍,导致病毒致癌基因表达上调,并且和附近的基因产物共同扩增。
细胞内部核转移全部或部分的线粒体DNA序列在癌症基因组中也存在(在2%的肿瘤中,尤其是皮肤癌、肺癌、乳腺癌中),但是线粒体DNA如何移动和插入基因组DNA的分子机制并没有完全阐明(截止2018)。大部分的体细胞核基因组整合线粒体DNA并不是单独发生的,而是和重排事件组合发生,认为,线粒体染色体片段可能在体细胞中DNA修复过程中充当“补充材料”或线形编织破损的核DNA片段[106]。
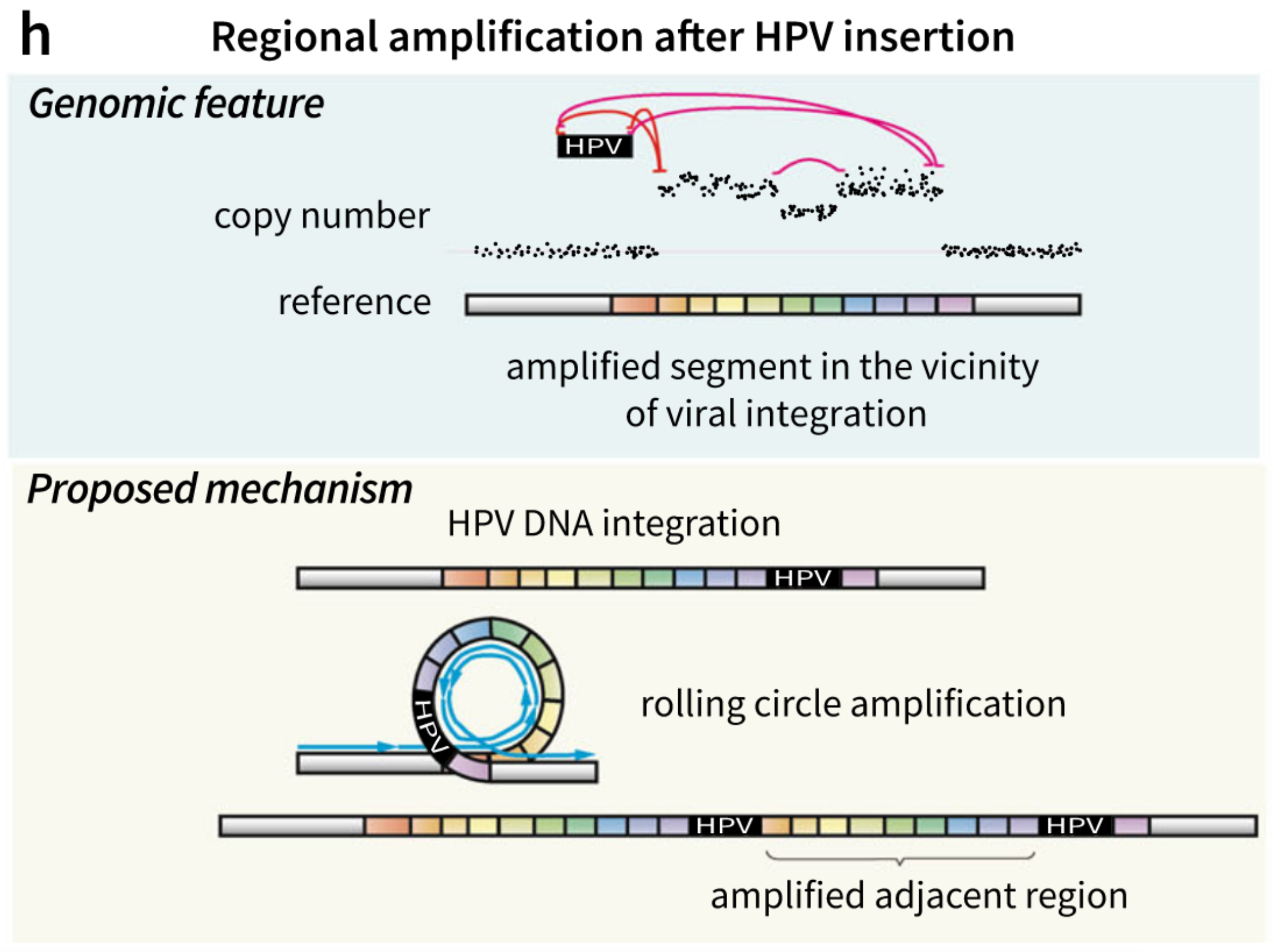
2018
结构变异的功能作用
结构变异对肿瘤发生和克隆性演化中的功能性结果至少可以分为四个直接的机制:
-
截断基因(truncation of genes),比如基因删除或破坏
-
对整个基因扩增,通过“剂量效应”来提升表达水平
-
融合基因的形成,比如肺癌中的
EML4-ALK和白血病中的BCR-ABL
前三种是传统的机制,第四种存在概念进展。
- 劫持增强子。比如:对肿瘤基因替换基因表达,包括
IRS4、SMARCA1、TERT等等[119],在乳腺癌中,乳腺癌组织特异性调控区域反复重复,表明正向选择压力的存在,很多非编码的结构变异可能会影响近端或远端的基因表达。
拷贝数变异具有的特征
- focal和arm-level染色体变异
在整个基因组上,最常见的体细胞拷贝数变异(SCNA)是短的染色体变异(focal),和几乎和染色体臂或整条染色体等长的染色体变异(arm-level)。[3] arm-level的染色体变异发生的占比大约是focal的30倍,且几乎所有的癌症类型中都是这样。认为这两者发生概率不同,意味着是分别发生的。
